ارزیابی بالینی (Evaluation Clinical) تجهیزات پزشکی چیست؟
ارزیابی بالینی به فرآیندي اطلاق می شود که طی آن ایمنی و عملکرد تجهیز پزشکی با به کارگیري روي موضوع انسان ارزیـابی میشود. در این فـرآیند، دادههاي بالینی حاصل از کـاربرد وسیله پزشکی روي انسان پـایش، ثبت، پردازش و گزارش میشود.
در ارزیابی بالینی، عملکرد محصول در راستاي کاربرد تعریف شده از سـوي سازنده، ایمن بودن از خطر و ایجاد عارضه ناخواسته بـراي بیمار، کـاربر و محیط، مورد ارزیابی قرار میگیرد.
تولیدکنندگان، ایمنی و عملکرد محصولات تولیدي خود را در شرایط پیش بالین ((Pre clinical و در بالین ((clinical میآزمایند. ارزیابی پیش بالین بـه معناي آزمودن وسیله پزشکی در شرایط آزمایشگاه و بدن حیوان میباشد.
ارزیابی بالینی در کشورهاي توسعه یافته صاحب نظام رگولاتوري تجهیزات پزشکی نظیر اتحادیه اروپا و آمریکا بسیار مورد توجه قرار گرفته است و طبق قوانین تدوین شده، انجام آن پس از تایید آزمونهاي پیش بالین و با کسب مجوز شروع ارزیابی بالینی از سازمانهاي مقررات گذار مانند کمیسیون اتحادیه اروپا و سازمان غذا و داروي آمریکا ( (FDA انجام میشود.
ارزیابی بالینی از دیدگاه اداره کل تجهیزات پزشکی، یکی از مراحل مهم ارزیابی کالا محسوب میشود و طبق آیین نامه “فعالیت در حوزه تجهیزات پزشکی” ابلاغی وزارت بهداشت، درمان و آموزش پزشکی، بخشی از فرآیند ارزیابی و اثبات عملکرد و ایمنی تجهیزات پزشکی تعریف شده است.
گزارش ارزیابی بالینی (CER) و ۷ مراحل ایجاد آن
در این مقاله قصد داریم به مفهوم و اهمیت گزارش ارزیابی بالینی (CER) در دستگاه های پزشکی بپردازیم . گزارش ارزیابی بالینی (CER) نتایج ارزیابی بالینی دستگاه پزشکی شما را مستند می کند. یک CER شامل داده های بالینی تجزیه و تحلیل شده است که از تحقیقات بالینی دستگاه شما یا نتایج سایر مطالعات روی دستگاه های تقریباً مشابه جمع آوری شده است. ایجاد CER ساده به نظر می رسد، اما یک کار پیچیده و منابع فشرده است و بهتر است آن را به متخصصانی مانند ما بسپارید. برای درخواست مشاوره با راه های ارتباطی ما در تماس باشید یا از طریق پر کردن فرم شناخت یا صدور ایزو ، کارشناسان ما با شما تماس خواهند گرفت.
فهرست مطلب
گزارش ارزیابی بالینی (CER) چیست؟
گزارش ارزیابی بالینی یک استاندارد اجرایی است که در طول عمر دستگاه پزشکی به روز می شود. هنگامی که اطلاعات جدیدی در مورد دستگاه پزشکی از طریق خدمات پس از فروش یا جستجوی متون جدید در دسترس قرار می گیرد، گزارش ارزیابی بالینی(CER) باید برای منعکس کردن این مورد بازنگری شود. حتی اگر اطلاعات جدیدی دریافت نشد باز هم گزارش ارزیابی بالینی(CER) باید از طبق رویه داخلی به روز شود.
بروز رسانی گزارش ارزیابی بالینی (CER) به چه صورت می باشد ؟
گزارش ارزیابی بالینی برای دستگاه های پزشکی کلاس III یا کلاس IIb باید سالانه به روز شود. گزارش ارزیابی بالینی(CER) باید هر دو تا پنج سال یکبار برای دستگاه هایی که خطر عمده ای ندارند به روز شود.
هدف از تدوین گزارش ارزیابی بالینی (CER) چیست؟
یک گزارش ارزیابی بالینی(CER) که به درستی گرد آوری و تدوین شده، به تنظیمکنندهها مانند سازمانهای آگاه، مقامات ذیصلاح، بیماران و پزشکان اطمینان میدهد که دستگاههای پزشکی با رعایت دقیق دستورالعملها تأیید شدهاند، بنابراین تضمین می کند که مزایای بالقوه آنها بر خطرات احتمالی مرتبط با استفاده از آنها برتری دارد.
همچنین برای ایجاد یک رویکرد یکسان با تولیدکنندگان و سازمانهای اطلاعرسانی شده (NBs) درگیر در رویههای ارزیابی انطباق، ماده ۶۱ MDR و دستورالعملهای MEDDEV 2.7.1 Rev 4 از نظر قانونی غیرالزامآور استفاده شد.
ماده ۶۱ MDR چیست؟
ماده ۶۱ مستلزم تدوین و بهروزرسانی مکرر گزارش ارزیابی بالینی برای تجهیزات پزشکی است که برای بررسی و تجزیه و تحلیل دادههای بالینی مربوط به یک دستگاه پزشکی به منظور تأیید ایمنی و عملکرد بالینی آن استفاده میشود.
همه تولیدکنندگان تجهیزات پزشکی باید نشان دهند که محصولات آنها الزامات ایمنی و عملکرد عمومی ۲۰۱۷/۷۴۵ (GSPR) را برآورده می کند. برای انجام این تعهدات، سازندگان دستگاههای پزشکی باید دادههای موجود را بررسی کرده و یک گزارش ارزیابی بالینی(CER) مطابق با MDR ماده ۶۱ و ضمیمه XIV ایجاد کنند، که دادههای نظارت پس از فروش را نیز پوشش میدهد.
ارتباط گزارش ارزیابی بالینی(CER) با CE چیست؟
گزارش ارزیابی بالینی(CER) یک جزء کلیدی از فرآیند علامت گذاری CE است، بنابراین هر دو با هم مرتبط هستند. بازار یک دستگاه در اتحادیه اروپا باید به CER نیاز داشته باشد و معتقد است که EUMDR بر اهمیت CER تاکید دارد و شامل الزامات ایمنی و عملکرد کلی، بررسی ارزیابی بالینی و مستندات است.
برای دریافت گواهینامه CE یا اعمال علامت CE بر روی یک دستگاه پزشکی، باید یک CER کامل در داخل پرونده فنی داشته باشیم. اتحادیه اروپا ۲۰۱۷/۷۴۵ الزامات خاصی برای مستندات گزارش ارزیابی بالینی تجهیزات پزشکی و تجزیه و تحلیل داده ها دارد.
مطالعه بیشتر : صدور گواهینامه CE بهمراه مشاوره اجرا
مقررات و راهنمایی برای گزارش ارزیابی بالینی(CER)
شواهد بالینی کامل جمعآوریشده در طول فرآیند ارزیابی بالینی باید در گزارش ارزیابی بالینی(CER) مستند شود و باید بخشی از اسناد فنی باشد که از ارزیابی انطباق دستگاه پشتیبانی میکند.
ارزیابی بالینی راهنمای تولیدکنندگان و سازمانهای اطلاعرسانی شده بر اساس مقررات ارزیابی بالینی، همچنین در مورد الزامات یک گزارش ارزیابی بالینی(CER) بیان میکند. طبق این دستورالعمل، گزارش ارزیابی بالینی(CER) باید حاوی اطلاعات کافی برای خواندن و درک توسط یک طرف مستقل مانند یک مرجع نظارتی یا سازمان آگاه باشد. بنابراین، باید جزئیات کافی برای درک معیارهای جستجوی اتخاذ شده توسط ارزیابان، داده های موجود، همه فرضیات انجام شده و همه نتیجه گیری های بدست آمده ارائه دهد.
ویژگی های گزارش ارزیابی بالینی (CER) چیست؟
- گزارش ارزیابی بالینی (CER) بدون توجه به مثبت یا منفی بودن داده ها باید عینی باشد.
- گزارش ارزیابی بالینی (CER)باید به اندازه کافی دقیق باشد تا در بین بازبینان NB و کارشناسان موضوع اعتماد ایجاد کند.
- گزارش ارزیابی بالینی (CER) دستگاههای تاسیسشده میتواند به دادههای بازار موجود تکیه کند، در حالی که دستگاههای جدید دستگاههای مشابه و معادل را دادهاند.
مراحل هفت گانه ایجاد یک گزارش ارزیابی بالینی(CER)
رهنمودهای MDR ماده ۶۱ و MEDDEV 2.7.1 Rev. 4 به آسانی قابل درک نیستند، به ویژه به دلیل نوع دستگاه، کلاس خطر، تغییرات در طراحی، وضعیت هنر، ویژگیها، اهداف درمانی، استفاده مورد نظر و بیمار مورد نظر. گروه ها. دستورالعمل های فوق فقط به تولید کنندگان دارای مفاهیم اجازه می دهد تا روش مناسب را انتخاب کرده و به طور مستقل یک گزارش ارزیابی بالینی(CER) را ایجاد کنند.
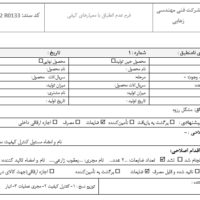
مرحله ۱: محدوده ارزیابی بالینی را مشخص کنید.
دامنه ارزیابی بالینی باید شامل شناسایی دستگاههای تحت پوشش این گزارش ارزیابی بالینی، محصولات، مدلها، اندازهها، نسخههای نرمافزار، لوازم جانبی، موجود بودن آن در بازار، از چه زمانی، در چه مناطقی، تاریخچه دستگاه، در صورت لزوم باشد. به روز رسانی در طرح شامل تاریخ اصلاحات گذشته با دلایل و توضیحات، حجم فروش، تغییرات از آخرین گزارش، شناسایی بخش هایی از CER که مربوط به اطلاعات جدید بوده و اصلاح شده اند ذکر شود.
مرحله ۲: برنامه ریزی ارزیابی بالینی
برنامه ریزی روشی مناسب برای شناسایی، جمع آوری و تجزیه و تحلیل داده های بالینی با برنامه زمانی مناسب و تیم ارزیابی بالینی. همچنین، برای توسعه دامنه ارزیابی بالینی که باید بر روی دستگاه پزشکی انجام شود.
مرحله ۳: داده های تولید شده و نگهداری شده توسط سازنده.
تمام تحقیقات بالینی قبل از عرضه به بازار مانند گزارشهای تست پایه شامل دادههای تأیید و اعتبار و دادههای بالینی تولید شده از فعالیتهای مدیریت ریسک و برنامههای PMS است.
مرحله ۴: پیشینه، دانش فعلی، وضعیت هنر
مروری بر دانش یا وضعیت هنر فعلی مورد نیاز برای انجام صحیح ارزیابی و تجزیه و تحلیل دادههای بالینی دستگاه تحت ارزیابی و دستگاه معادل.
خلاصه و توجیه استراتژی جستجوی ادبیات بکار رفته برای بازیابی اطلاعات در مورد دانش فعلی، از جمله منابع، کلمات کلیدی، معیارهای انتخاب مورد استفاده، اقدامات کنترل کیفیت، نتایج، تعداد و نوع ادبیات، مرتبط بودند. معیارهای ارزیابی نیز برای جمع بندی استفاده شد.
مرحله ۵: داده های بالینی از ادبیات
طرح اولیه شناسایی سه منبع کلیدی داده است که می تواند در گزارش ارزیابی بالینی باشد.
- داده های قابل اعتماد نظرات مطالعه منتشر شده در مجلات پزشکی.
- داده های داخلی منتشر نشده.
- داده های نظارت بر شکایت پس از بازار.
- داده های رجیستری
مرحله ۶: خلاصه و ارزیابی داده ها
کیفیت کلی دادههایی را که معیارهای ورود و خروج را برآورده میکنند، ارزیابی کنید. تجزیه و تحلیل داده ها اجازه می دهد تا تعیین کنید که داده ها تا چه حد برای نتیجه گیری مفید هستند.
مرحله ۷: تجزیه و تحلیل کامل
تجزیه و تحلیل داده ها از نظر ایمنی و عملکرد آنها یک چالش بزرگ است زیرا کیفیت داده های بالینی به طور گسترده ای از مطالعه ای به مطالعه دیگر بر اساس ایمنی، مشخصات ریسک فایده، عملکرد و پذیرش عوارض جانبی متفاوت است.
گزارش ارزیابی بالینی باید خطرات احتمالی ناشی از دستگاه را که در گزارش مدیریت ریسک شناسایی شده است، در نظر بگیرد. تمام خطرات احتمالی و اقدامات کنترل ریسک از گزارش مدیریت ریسک باید در نتیجهگیری CER مورد توجه قرار گیرد.
اطلاعات در مورد جمعیت مورد مطالعه و تشخیص، هدف مورد نظر، عوارض جانبی باید به تفصیل تجزیه و تحلیل شود.
منظور از دستگاه معادل چیست؟
← وضعیت بالینی تحت درمان، محل استفاده در بدن و جمعیت بیمار.
← طراحی تجهیزات پزشکی، مصالح ساختمانی، ابعاد، نحوه عملکرد).
← ماهیت و ویژگی های بیولوژیکی
برنامه اقدام (SOP) چیست؟
به خوبی تعریف شده برای جستجوی متون ایجاد کنید تا مطمئن شوید که سعی می کنید تمام داده های ممکن مربوط به دستگاه مورد نظر را پیدا کنید. این طرح باید شامل معیارهای گنجاندن و حذف بر اساس پیچیدگی های دستگاه شما باشد و از تجزیه و تحلیل داده های یکسان از منابع متعدد و کاهش زمان جستجو اجتناب کند.
هنگامی که یک محصول که بصورت مستقیم با انسان سر و کار دارد ساخته می شود نیاز دارد که قبل از استفاده توسط انسان مورد آزمایش قرار گیرد در این آزمایش محصول بصورت غیر مستقیم و امن توسط انسان آزمایش می شود
روش اجرایی یا دستورالعمل ارزیابی بالینی استانداردها و قوانین به کارگیری محصولات حساس بخصوص تجهیزات پزشکی را شرح می دهد
مقاله در حال نگارش …