Post-Market Performance Follow-up چیست؟
به پیگیری های بالینی نسبت به عملکرد سیستم های تشخیصی آزمایشگاهی (IVD) پس از ارائه به بازار و استفاده توسط کاربران PMPF می گویند. PMPF یک فرآیند پیوسته می باشد که برای بروزرسانی مداوم ارزیابی عملکرد محصولات IVD در طول عمر مورد انتظارشان استفاده می شود. در واقع یک فرآیند است که در آن سازنده یا توزیع کننده یک IVD، عملکرد، اعتبار علمی، ایمنی، خطرات نوظهور و سیستماتیک محصول خود را در شرایط واقعی کاربرد ارزیابی می کند.
Post-Market Performance Follow-up به عنوان بخشی از Post Market Surveillance می باشد که نیاز است حتما در سیستم مدیریت کیفیت تعریف شود. در الزامات IVDR 2017/746، در Annex XIII بخش B چگونگی تهیه و اجرای PMPF اشاره شده است. حتما میبایست میان Post-Market Performance Follow-up با مستندات محصول از جمله مدیریت ریسک، ارزیابی عملکرد محصول، خلاصه ایمنی و عملکرد محصول و … ارتباط دو سویه برقرار باشد.
مزایای استفاده از PMPF
مزایای استفاده از:PMPF
ابزار مهمی برای سازندگان جهت شناسایی و رسیدگی به هرگونه خطر، نقص، چالش یا پیامدهای نامطلوب مرتبط با IVD تولیدی
همچنین انطباق با الزامات و نظارت دقیق رگولاتورها و مقامات را تضمین می کند.
همچنین به سازندگان کمک می کند تا کارایی، اثربخشی و کاربرپسندی دستگاه های خود را بهبود بخشند.
اهداف Post-Market Performance Follow-up
- تأیید مستمر عملکرد، اثربخشی و ایمنی IVD در طول عمر محصول
- اسایی ریسک ها و محدودیت های ناشناخته قبلی مرتبط با عملکرد و موارد منع مصرف
- شناسایی و تجزیه و تحلیل خطرات اضطراری بر اساس شواهد واقعی.
- حصول اطمینان از قابل قبول بودن مستمر نسبت فایده به ریسک.
- شناسایی سوء استفاده سیستماتیک احتمالی یا استفاده بدون برچسب از IVD، با هدف تأیید صحت هدف مورد نظر.
- جمع آوری و تحلیل داده های عملکردس مربوط به IVD و محصولات مشابه در بازاربازنگری طراحی و به روز رسانی برچسب گذاری و راهنمای کاربر در صورت نیاز
برای انجام Post-Market Performance Follow-up سازنده یا توزیع کننده باید چه مراحلی را طی کند
- اولین قدم تهیه یک طرح PMPF خوب است که شامل هدف، روش، منابع، زمانبندی و مسئولین PMPF می باشد و میبایست به عنوان بخشی از طرح PMS مستند شود. هر دو برنامه بخشی از مستندات فنی محصول می باشند.
- اجرای طرح PMPF با استفاده از روشهای مناسب مانند نظرسنجیها، مصاحبه ها، آزمایشهای آزمایشگاهی و غیره.
- هر بار که طرح PMPF اجرا می شود، یک گزارش PMPF میبایست تهیه شود
- گزارش دادهها و نتایج PMPF به صورت منظم و دقیق
- بکارگیری نتایج PMPF در گزارش عملکرد محصول IVD (PER)
تفاوت PMPF و PMCF
PMCF یک فرآیند پیوسته در راستای پیگیری بالینی یک تجهیز پزشکی پس از ورود به بازار و استفاده در بالین بیمار می باشد که گزارش ارزیابی بالینی تجهیز پزشکی را بروز می نماید. مشابه همان فرآیند در راستای پیگیری بالینی عملکرد IVD ها ولی PMPF تهیه و اجرا می شود که گزارش ارزیابی عملکرد را بروز می نماید.
مرجع تهیه و اجرای PMPF ، IVDR می باشد ولی مرجع تهیه و اجرای PMCF، MDR می باشد.
روند اجرای PMPF برای IVD
ابتدا میبایست طرحهای Post-Market Performance Follow-up و Post-Market Surveillance تهیه شود، سپس پس از اجرای PMPF، فایلهای مدیریت ریسک، گزارش ارزیابی عملکرد محصول برای کلاسهای خطر C, D، PSUR و SSP بروز گردد.
چه زمانی نوشتن طرح PMPF الزامی است؟
چه زمانی اجرای طرح PMPF الزامی است؟
چگونه دستورالعمل PMPF را تهیه کنیم؟
چه مراجعی برای نوشتن طرح PMPF وجود دارد؟
اجزای اصلی طرح PMPF چیست؟
پیگیری پس از بازار (PMCF)
مقررات تجهیزات پزشکی اروپا (EU-MDR) سطح الزامات نظارتی را در سراسر صنعت تجهیزات پزشکی افزایش داده است، به ویژه در مورد داده های بالینی و جمع آوری شواهد. انتظارات برای نظارت پس از بازار (PMS) افزایش یافته است که منجر به تاکید بیشتر بر پیگیری بالینی پس از بازار (PMCF) می شود.
نظرسنجی PMCF
PMCF از تولیدکنندگان میخواهد که ایمنی و عملکرد دستگاههای خود را بهطور فعال ارزیابی کنند، و این دادهها را در طول چرخه عمر محصول ثبت کنند. اگرچه کارآزماییهای بالینی تصادفیسازی شده و ثبتها سطوح بالاتری از شواهد را ارائه میدهند، اما ممکن است برای دستگاههای خاصی امکانپذیر نباشد. از سوی دیگر، نظرسنجی PMCF به کار، هزینه و زمان کمتری نیاز دارد.
ما چه کار می کنیم؟
Purdie Pascoe برای بررسیهای PMCF با کیفیت بالا (هم سطح عمومی کاربر نهایی (سطح 4) و هم با کیفیت بالا / سطح بیمار (سطح 8)) یک رویکرد بهترین عملکرد را ایجاد کرده است که توسط تنظیمکنندههای اتحادیه اروپا و مطابق با مقررات GDPR مطابقت دارد.
ما قبلاً بیش از 300 نظرسنجی سفارشی PMCF را در انواع مختلف دستگاه ها و طبقه بندی خطرات تکمیل کرده ایم.
Purdie Pascoe می تواند در طراحی، اجرا، جمع آوری داده ها و گزارش نظرسنجی های PMCF شما را پشتیبانی کند. اطمینان حاصل کنید که امروز همه چیز را برای مطابقت با EU-MDR در اختیار دارید.
اداره تولید و ثبت تجهیزات و فرآورده های آزمایشگاهی اداره کل تجهیزات و ملزومات پزشکی سازمان غذا و دارو :
ضرورت انجام پیگیری مستمر ارزیابی عملکرد پس از فروش “PMPF” توسط تولید کنندگان تجهیزات و فرآورده های آزمایشگاهی
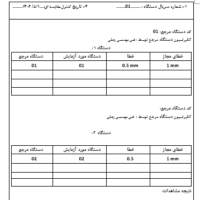
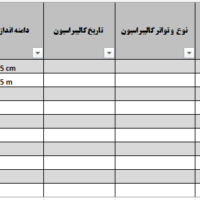
با عنایت به ضرورت انجام پیگیری مستمر ارزیابی عملکرد پس از فروش (PMPF) و با توجه به اینکه در مقررات جدید ارزیابی تطابق محصول در دنیا، PMPF به عنوان یک الزام در نظر گرفته شده است، ضروری است طرح (پلن) و رویههای اجرایی تعریفشده PMPF به عنوان بخشی از برنامه سیستم نظارت پس از فروش (PMS) توسط تولیدکننده در فایل فنی (تکنیکال فایل) پیادهسازی و مستندسازی شود. برای این منظور تولیدکنندگان میتوانند به اسناد راهنمای پیوست مراجعه نمایند.
لازم به ذکر است برای هر وسیله پزشکی، تولیدکنندگان باید یک سیستم نظارت پس از فروش (PMS) را به گونه ای برنامه ریزی، زمانبندی، ایجاد، مستندسازی، پیاده سازی، نگهداری و به روز رسانی کنند که متناسب با کلاس خطر و متناسب با نوع وسیله پزشکی باشد. آن سیستم باید بخشی جدایی ناپذیر از سیستم مدیریت کیفیت سازنده باشد. سیستم نظارت پس از فروش (PMS) باید برای جمعآوری فعال و سیستماتیک دادههای مربوطه در مورد کیفیت، عملکرد و ایمنی یک وسیله پزشکی در تمام طول عمر آن و نتیجه گیری لازم و تعیین، اجرا و نظارت بر هرگونه اقدام پیشگیرانه و اصلاحی مناسب باشد.
PMPF باید به عنوان یک فرآیند مستمر نگریسته شود که داده های ارزیابی عملکرد را جمع آوری، ثبت و به روز نگه می دارد و باید در طرح نظارت پس از فروش (PMS) سازنده مورد توجه قرار گیرد. (یادآوری می شود که PMPF بخشی از PMS می باشد.( هنگام انجام PMPF تولیدکننده باید به طور فعال داده های ارزیابی عملکرد تجهیزات و فرآورده های آزمایشگاهی مورد استفاده، داده های ارزیابی عملکرد مرتبط به تجهیزات و و فرآورده های آزمایشگاهی مشابه در بازار و منابع علمی معتبر مرتبط را جمع آوری و ارزیابی کند و باید شامل رویه ای با هدف تأیید ایمنی، عملکرد و اثربخشی در طول عمر مورد انتظار وسیله پزشکی، اطمینان از قابل قبول بودن مستمر خطرات شناسایی شده و شناسایی خطرات نوظهور بر اساس شواهد واقعی بمنظور مدیریت ریسک، بررسی داده های پس از تولید و بازنگری طراحی در صورت نیاز باشد.